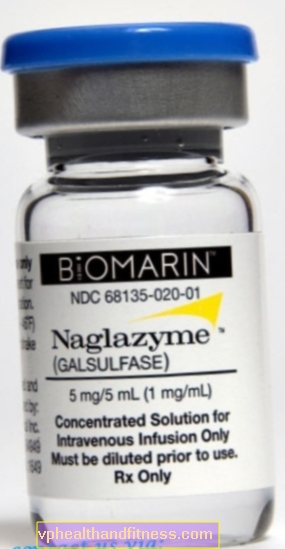
1 ml oppløsning inneholder 1 mg galsulfase. Preparatet inneholder natrium.
| Navn | Innholdet i pakken | Virkestoffet | Pris 100% | Sist endret |
| Naglazyme | 1 hetteglass med 5 ml, ferdig tilberedes løsning til inf. | Galsulfase | 2019-04-05 |
Handling
Et stoff som påvirker fordøyelseskanalen og stoffskifteproduktene. MPS VI er en heterogen og multisystemforstyrrelse preget av mangel på 4-sulfatase-N-acetylgalaktosamin, en lysosomal hydrolase som katalyserer hydrolysen av de terminale glykosaminoglycansulfatdermatansulfatrester. Redusert eller mangel på enzymaktivitet fører til opphopning av dermatansulfat i mange typer celler og vev. Begrunnelsen for behandlingen er å gjenopprette enzymatisk aktivitet som er tilstrekkelig til å hydrolysere det akkumulerte substratet og forhindre ytterligere akkumulering. Cmax var 2357 (± 1560) ng / ml, gjennomsnittlig T0,5 i eliminasjonsfasen var 22,8 (± 10,7) minutter i uke 24. Galsulfase gjennomgår peptidhydrolyse. Nyresekresjon av galsulfase bidrar lite til eliminering av stoffet fra kroppen.
Dosering
Det er viktig å starte behandlingen så tidlig som mulig før du ser irreversible kliniske symptomer på sykdommen. Behandlingen bør være under oppsyn av en lege med erfaring i behandling av pasienter med MPS VI eller andre arvelige metabolske sykdommer. Naglazyme bør administreres i en passende klinisk setting med umiddelbar tilgang til livsstøtteutstyr for behandling av livstruende nødsituasjoner. Den anbefalte dosen galsulfase er 1 mg / kg kroppsvekt. gitt en gang i uken som en intravenøs infusjon over 4 timer. Spesielle pasientgrupper. Eldre: Sikkerheten og effekten av preparatet er ikke fastslått, og det er ingen anbefalinger angående en alternativ doseringsplan. Nyre- og leverlidelser: Sikkerheten og effekten av preparatet er ikke vurdert, og det er ingen anbefalinger for en alternativ doseringsplan for disse pasientene. Barn og ungdom: Det er ingen spesielle regler som bør vurderes når preparatet administreres til denne pasientgruppen. Administrasjonsmåte: Den opprinnelige infusjonshastigheten kan justeres slik at ca. 2,5% av den totale løsningen administreres i løpet av 1 time og det gjenværende volumet (ca. 97,5%) administreres i løpet av de neste 3 timene. Hos pasienter som er utsatt for væskevolumoverbelastning og som veier mindre enn 20 kg, bør du vurdere bruk av 100 ml infusjonsposer. I dette tilfellet bør infusjonshastigheten (ml / min) reduseres slik at den totale varigheten av infusjonen ikke er mindre enn 4 timer.
Indikasjoner
Langsiktig enzymsubstitusjon hos pasienter med en bekreftet diagnose av mucopolysakkaridose type VI (MPS VI; N-acetylgalactosamin 4-sulfatase-mangel; Maroteaux-Lamy syndrom). Hovedstøtten i behandlingen er behandlingen av unge pasienter <5 år med alvorlig sykdom, selv om pasienter <5 år ikke deltok i den sentrale fase 3-studien. Begrensede data er tilgjengelige for pasienter <1 år.
Kontraindikasjoner
Akutt eller livstruende overfølsomhet overfor virkestoffet eller overfor et eller flere av hjelpestoffene hvis overfølsomhet ikke kan kontrolleres.
Forholdsregler
Forsiktighet bør utvises ved behandling og behandling av pasienter med restriktiv lungesykdom, eller nøye overvåking av bruken av antihistaminer og andre beroligende midler. Bruk av positivt luftveistrykk under søvn og muligheten for trakeostomi i klinisk passende situasjoner bør vurderes. Infusjonen av medisinen kan være nødvendig å utsette hos pasienter med akutt febersykdom eller med luftveisproblemer. På grunn av potensialet for infusjonsassosierte reaksjoner (IAR), som forstås å bety eventuelle bivirkninger som oppstår under infusjonen eller før slutten av infusjonsdagen, anbefales det at pasienter blir premedisinert med antihistaminer i kombinasjon med antipyretika. eller uten dem, ca 30-60 min. før du begynner infusjonen av preparatet for å redusere risikoen for IAR-symptomer. Ved milde til moderate symptomer på IAR, bør du vurdere behandling med antihistaminer og paracetamol og / eller redusere infusjonshastigheten til mindre enn halvparten av responsraten. Ved enkelt alvorlige symptomer på IAR, bør infusjonen avbrytes til symptomene forsvinner og behandling med antihistaminer og paracetamol bør vurderes. Infusjonen kan startes på nytt med 50% -25% av hastigheten den reagerte på. Ved tilbakevendende moderat IAR-symptomer eller etterbehandling etter enkelt alvorlige IAR-symptomer, bør du vurdere premedisinering (med antihistaminer og paracetamol og / eller kortikosteroider) og redusere infusjonshastigheten til 50% -25% av hastigheten med forrige respons. Alvorlige allergifølsomhetsreaksjoner er mulige. Hvis de oppstår, anbefales det å avbryte preparatet umiddelbart og iverksette passende behandling. Gjeldende regler for håndtering av en nødssituasjon må overholdes. Pasienter som har opplevd en allergisk reaksjon under infusjonen av legemidlet, bør prøves på nytt med særlig forsiktighet; Spesielt opplært medisinsk personell og tilgjengelig gjenopplivningsutstyr (inkludert adrenalin) skal være tilstede under administrering. Akutt eller potensielt livstruende overfølsomhet som ikke kan kontrolleres er en kontraindikasjon for re-dosering. Preparatet inneholder natrium - forsiktighet bør utvises hos pasienter som er på diett med et begrenset natriuminnhold. Ryggmargekompresjon, også i livmorhalsområdet, med påfølgende myelopati er en kjent og alvorlig komplikasjon som kan være forårsaket av MPS VI - pasienter bør overvåkes for tegn og symptomer på ryggmargskompresjon (ryggsmerter, lammelse under trykkpunktet, inkontinens urin og avføring) og om nødvendig få passende pleie.
Uønsket aktivitet
Svært vanlig: faryngitt, gastroenteritt, areflexia, hodepine, konjunktivitt, hornhinneopasitet, øreplager, nedsatt hørsel, høyt blodtrykk, dyspné, nesetetthet, magesmerter, navlebrokk, oppkast, kvalme, ansiktsødem, utslett , elveblest, kløe, smerter, brystsmerter, frysninger, utilpashed, feber, leddsmerter. Vanlige: kramper, hypotensjon, apné, hoste, respirasjonssvikt, astma, bronkospasmer, erytem. Ikke kjent: anafylaktisk reaksjon, sjokk, parestesi, bradykardi, takykardi, cyanose, blekhet, larynxødem, hypoksi, hurtig pust.
Graviditet og amming
Legemidlet må ikke brukes under graviditet med mindre det er absolutt nødvendig. Amming bør stoppes under behandling med preparatet. Reproduksjonsstudier utført på rotter og kaniner som mottok stoffet i doser opp til 3 mg / kg / dag, viste ingen bevis for nedsatt fertilitet eller skadelige effekter på fosteret forårsaket av stoffet.
Preparatet inneholder stoffet: Galsulfase
Refusjonert medikament: NEI