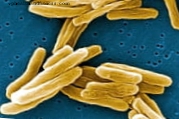
Mandag 27. januar 2014.- Forskere fra University of Zaragoza og Biomedical Research Center in Respiratory Disease Network (CIBERES) har deltatt i utviklingen av en ny familie av antibiotika mot bakteriene som forårsaker tuberkulose.
Arbeidet, som vil bli publisert i det vitenskapelige tidsskriftet 'Nature Medicine', er koordinert av forskere fra Memphis Hospital (USA) og vil forhindre at bakterien 'Mycobacterium tuberculosis' bruker sine egne resistensmekanismer mot disse nye antibiotikaene.
Tuberkulose er en av de smittsomme sykdommene med høyest forekomst over hele verden, med 8, 6 millioner tilfeller i henhold til 2012-data, og dette funnet vil favorisere utformingen av mer effektive antibiotika ved å modifisere den kjemiske strukturen og dermed unngå at bakterier avviser dem eller eksporterer til utlandet kontinuerlig.
Forskere har vist at en variasjon i den kjemiske strukturen til antibiotika kan være avgjørende for deres aktivitet, siden det påvirker betydelig når de blir gjenkjent eller ikke av strømningspumpene (utvisning) som bakterier har.
Utformingen av disse medikamentene er oppnådd fra det naturlige antibiotiske spektinomycinet ved kjemisk syntese, og de kalles spektinamid. Disse nye antibiotika hemmer eller inaktiverer syntesen av proteinmolekyler i bakterier, og hindrer samtidig fremveksten av resistente stammer.
For dette er strukturen til ribosomet, bakterieorganellen som de binder til og inaktiveres for å utføre sin antibakterielle virkning, tatt i betraktning. Det mest fremragende kjennetegn er dens nesten eksklusive aktivitet mot bakteriene som forårsaker tuberkulose (selv mot stammene som har utviklet resistens mot medisiner), de lave nivåene av toksisitet de presenterer, og deres effektivitet i å dempe utviklingen av tuberkulose i Eksperimentelle dyr
Studien begynte for nesten to tiår siden, ved hjelp av José Antonio Aínsa, fra forskningsgruppen Mycobacterial Genetics ved University of Zaragoza, da han startet en ny linje med arbeid med utvikling av antimikrobielle stoffer og motstandsmekanismer.
Innenfor denne rammen begynte Aínsa å studere proteiner av 'M. tuberkulose 'kalt utstrømningspumper, som gjenkjenner antibiotika som trenger inn i bakterien og driver dem ut i utlandet, og dermed får antibiotika til å miste aktivitet og bakteriene kan bli resistente mot dem.
En av disse avløpspumpene, kalt Tap (Rv1258c), kan transportere noen av de nye spektaminamidene, avhengig av deres kjemiske struktur, og faktisk har den blitt brukt til å velge de spektinamider som ikke kan transporteres, og derfor de er mer aktive, noe som kan redusere dosen som er nødvendig for å eliminere bakterier.
Samarbeidet mellom aragoniske forskere og Richard E. Lee fra St. Jude Children's Research Hospital i Memphis fant ikke sted før i 2010, da de møttes i Boston på en kongress i American Society of Microbiology.
I dette møtet presenterte Lee syntesen av spektinamid, og hadde funnet ut at noen derivater som var veldig potente til å hemme ribosom. Imidlertid hadde de knapt aktivitet mot bakteriene. Aínsa presenterte en avhandling som han hadde bygget en mutant som ikke produserte Tap efflux pumpe (Rv1258c) og hadde mistet evnen til å motstå visse antibiotika som spektinomycin.
Siden spectinomycin er det antibiotikumet som spectinamide er syntetisert fra, oppstod det umiddelbart samarbeid mellom de to for å verifisere om Tap efflux pumpen (Rv1258c) kunne transportere det mindre aktive spectinamid, som faktisk ble demonstrert.
Kilde:
Tags:
Kjønn velvære Nyheter
Arbeidet, som vil bli publisert i det vitenskapelige tidsskriftet 'Nature Medicine', er koordinert av forskere fra Memphis Hospital (USA) og vil forhindre at bakterien 'Mycobacterium tuberculosis' bruker sine egne resistensmekanismer mot disse nye antibiotikaene.
Tuberkulose er en av de smittsomme sykdommene med høyest forekomst over hele verden, med 8, 6 millioner tilfeller i henhold til 2012-data, og dette funnet vil favorisere utformingen av mer effektive antibiotika ved å modifisere den kjemiske strukturen og dermed unngå at bakterier avviser dem eller eksporterer til utlandet kontinuerlig.
Forskere har vist at en variasjon i den kjemiske strukturen til antibiotika kan være avgjørende for deres aktivitet, siden det påvirker betydelig når de blir gjenkjent eller ikke av strømningspumpene (utvisning) som bakterier har.
Utformingen av disse medikamentene er oppnådd fra det naturlige antibiotiske spektinomycinet ved kjemisk syntese, og de kalles spektinamid. Disse nye antibiotika hemmer eller inaktiverer syntesen av proteinmolekyler i bakterier, og hindrer samtidig fremveksten av resistente stammer.
For dette er strukturen til ribosomet, bakterieorganellen som de binder til og inaktiveres for å utføre sin antibakterielle virkning, tatt i betraktning. Det mest fremragende kjennetegn er dens nesten eksklusive aktivitet mot bakteriene som forårsaker tuberkulose (selv mot stammene som har utviklet resistens mot medisiner), de lave nivåene av toksisitet de presenterer, og deres effektivitet i å dempe utviklingen av tuberkulose i Eksperimentelle dyr
STUDIEEN BEGYNNER 20 ÅR I GANG
Studien begynte for nesten to tiår siden, ved hjelp av José Antonio Aínsa, fra forskningsgruppen Mycobacterial Genetics ved University of Zaragoza, da han startet en ny linje med arbeid med utvikling av antimikrobielle stoffer og motstandsmekanismer.
Innenfor denne rammen begynte Aínsa å studere proteiner av 'M. tuberkulose 'kalt utstrømningspumper, som gjenkjenner antibiotika som trenger inn i bakterien og driver dem ut i utlandet, og dermed får antibiotika til å miste aktivitet og bakteriene kan bli resistente mot dem.
DOSER NØDVENDIG FOR å eliminere bakterier reduseres
En av disse avløpspumpene, kalt Tap (Rv1258c), kan transportere noen av de nye spektaminamidene, avhengig av deres kjemiske struktur, og faktisk har den blitt brukt til å velge de spektinamider som ikke kan transporteres, og derfor de er mer aktive, noe som kan redusere dosen som er nødvendig for å eliminere bakterier.
Samarbeidet mellom aragoniske forskere og Richard E. Lee fra St. Jude Children's Research Hospital i Memphis fant ikke sted før i 2010, da de møttes i Boston på en kongress i American Society of Microbiology.
I dette møtet presenterte Lee syntesen av spektinamid, og hadde funnet ut at noen derivater som var veldig potente til å hemme ribosom. Imidlertid hadde de knapt aktivitet mot bakteriene. Aínsa presenterte en avhandling som han hadde bygget en mutant som ikke produserte Tap efflux pumpe (Rv1258c) og hadde mistet evnen til å motstå visse antibiotika som spektinomycin.
Siden spectinomycin er det antibiotikumet som spectinamide er syntetisert fra, oppstod det umiddelbart samarbeid mellom de to for å verifisere om Tap efflux pumpen (Rv1258c) kunne transportere det mindre aktive spectinamid, som faktisk ble demonstrert.
Kilde:















-przyczyny-objawy-leczenie.jpg)


