1 hetteglass inneholder 5 mg eller 35 mg agalsidasebeta.
| Navn | Innholdet i pakken | Virkestoffet | Pris 100% | Sist endret |
| Fabrazyme | 10 hetteglass, pulver for tilberedning endelig løsning til inf. | Agalsidasase beta | 2019-04-05 |
Handling
Agalsidase beta - en rekombinant form av human α-galaktosidase A, produsert ved rekombinant DNA-teknologi ved bruk av kinesisk hamster ovariecellekultur (aminosyresekvensen til den rekombinante formen, så vel som nukleotidsekvensen som koder for den, er identisk med den naturlige formen av α-galaktosidase). Det er et enzym som katalyserer hydrolysen av GL-3. Mangel på aktivitet i løpet av Fabry sykdom forårsaker GL-3 lagring i mange typer celler, inkludert endotelceller og parenkymale celler. Behandling med preparatet fører til en betydelig reduksjon av GL-3 avleiringer i nyrene, hjertet og huden. Etter intravenøs administrering fjernes agalsidasase raskt fra sirkulasjonen og tas opp av lysosomene i blodkarets endotelceller og parenkymale celler. T0,5 i eliminasjonsfasen er 45-100 min.
Dosering
Intravenøst. Behandlingen skal utføres av en lege med erfaring i behandling av pasienter med Fabry sykdom eller andre arvelige metabolske sykdommer. Den anbefalte dosen er 1 mg / kg kroppsvekt. en gang annenhver uke Hos noen pasienter, etter startdosen på 1 mg / kg. annenhver uke i 6 måneder, en dose på 0,3 mg / kg brukt annenhver uke kan støtte reduksjon av GL-3 forekomster i visse celletyper; den langsiktige kliniske relevansen av disse observasjonene er imidlertid ikke fastslått. Spesielle pasientgrupper. Ingen dosejustering er nødvendig hos pasienter med nyreinsuffisiens. Studier er ikke utført hos pasienter med leverinsuffisiens. Sikkerhet og effekt er ikke fastslått hos pasienter> 65 år; ingen doseringsregimer kan for øyeblikket anbefales. Barn 0-7 år har ikke blitt studert, og sikkerheten og effekten av legemidlet er ikke fastslått i denne aldersgruppen; ingen doseringsregimer kan anbefales. Ingen dosejustering er nødvendig for barn i alderen 8 til 16 år. Måte å gi. Pulveret til konsentrat til infusjonsvæske, oppløsning må rekonstitueres med vann til injeksjonsvæsker, deretter fortynnes med 0,9% intravenøs natriumkloridoppløsning og administreres som en intravenøs infusjon. Den opprinnelige infusjonshastigheten bør ikke overstige 0,25 mg / min (15 mg / t). Hvis pasienten tåler medisinen godt, kan infusjonshastigheten økes gradvis med påfølgende infusjoner. Hjemmeinfusjoner kan vurderes hos pasienter som tåler dem godt. Pasienter som opplever bivirkninger under hjemmeinfusjoner, må stoppe infusjonen umiddelbart og oppsøke helsepersonell. Gjennomføring av påfølgende infusjoner kan kreve kliniske forhold. Dosen og infusjonshastigheten hjemme bør holdes konstant og bør ikke endres uten tilsyn av helsepersonell.
Indikasjoner
Langvarig enzymerstatningsterapi hos pasienter med en bekreftet diagnose av Fabrys sykdom (α-galaktosidase A-mangel). Legemidlet er indisert hos voksne, ungdommer og barn i alderen ≥8 år.
Kontraindikasjoner
Livstruende overfølsomhet (anafylaktisk reaksjon) overfor virkestoffet eller overfor et eller flere av hjelpestoffene.
Forholdsregler
Agalsidasase beta (r-hαGAL) er et rekombinant protein, derfor kan det forventes utvikling av IgG-antistoffer hos pasienter med liten eller ingen gjenværende enzymaktivitet; IgG-antistoffer mot r-hαGAL utvikler seg vanligvis hos de fleste pasienter innen 3 måneder fra den første administrasjonen av preparatet. Pasienter med antistoffer mot r-hαGAL har økt risiko for infusjonsrelaterte reaksjoner, og hos slike pasienter bør det utvises forsiktighet når man administrerer agalsidase beta på nytt; antistoffnivåer bør overvåkes. For milde til moderate infusjonsrelaterte reaksjoner kan administrasjonshastighetene for medisiner reduseres til 10 mg / t og / eller premedisineres med antihistaminer, paracetamol, ibuprofen og / eller kortikosteroider. Som med andre intravenøse proteinholdige medisiner, kan overfølsomhetsreaksjoner av allergisk type forekomme; i tilfelle alvorlige allergiske eller anafylaktiske reaksjoner, bør administreringen av preparatet avbrytes umiddelbart og passende behandling startes. Hos pasienter med avansert nyresykdom kan nyreeffekten av agalsidasase-behandling være begrenset.
Uønsket aktivitet
Svært vanlig: hodepine, parestesi, kvalme, oppkast, frysninger, feber, forkjølelse. Vanlige: nasofaryngitt, svimmelhet, søvnighet, hypestesi, brennende følelse, slapphet, synkope, økt lakrimasjon, tinnitus, perifer svimmelhet, takykardi, hjertebank, bradykardi, rødme, hypertensjon, blekhet , hypotensjon, hetetokter, dyspné, tett nese, tetthet i halsen, tungpustethet, hoste, forverret andpustethet, magesmerter, smerter i øvre mage, ubehag i øvre mage, ubehag i magen, oral hypoestesi, diaré, kløe, elveblest, utslett, erytem, generalisert kløe, angioneurotisk ødem, ansiktsødem, makulopapulært utslett, smerter i ekstremiteter, muskelsmerter, ryggsmerter, muskelspasmer, leddsmerter, muskelspenning, muskuloskeletal stivhet, tretthet, ubehag i brystet, følelse av varme , tretthet, hevelse i lemmer, brystsmerter, asteni, smerter, hevelse i ansiktet, hypertermi. Mindre vanlige: rhinitt, hyperestesi, tremor, kløende øyne, okulær hyperemi, øreødem, øreplager, sinusbradykardi, perifer forkjølelse, bronkospasme, svelg / svulstsmerter, rhinoré, rask pust, overbelastning i øvre kanal Sykdommer i luftveiene, dyspepsi, dysfagi, marmorering av cyanose, erytematøs utslett, kløende utslett, misfarging av huden, ubehag i huden, muskelsmerter, følelse av varme og kalde, influensalignende symptomer, smerter på infusjonsstedet, reaksjon på infusjonsstedet, trombose på injeksjonsstedet, ubehag, hevelse. Ikke kjent: anafylaktoid reaksjon, hypoksi, leukocytoklastisk vaskulitt, redusert oksygenering av blod. De fleste medikamentrelaterte bivirkningene kan tilskrives dannelse av IgG-antistoffer og / eller komplementaktivering. IgE-antistoffer ble påvist hos et lite antall pasienter. Legemidlets sikkerhetsprofil hos barn (> 7 år) og ungdom skiller seg ikke fra den som er sett hos voksne.
Graviditet og amming
Det bør ikke brukes under graviditet, med mindre det er klart nødvendig (det er utilstrekkelige data om bruk av stoffet hos gravide kvinner). Agalsidase beta kan overføres til morsmelk. Ettersom det ikke foreligger data om effekten på spedbarn, bør fôring avbrytes under behandlingen med preparatet.
Kommentarer
Svimmelhet, søvnighet og besvimelse kan forekomme på administrasjonsdagen, noe som kan begrense evnen til å kjøre bil eller bruke maskiner. Oppbevar stoffet ved 2-8 grader C.
Interaksjoner
Legemidlet skal ikke administreres med klorokin, amiodaron, monobenzon eller gentamicin på grunn av risikoen for hemming av intracellulær α-galaktosidaseaktivitet. Gitt metabolismen av agalsidase beta, ser det ikke ut til å være involvert i legemiddelinteraksjoner mediert av cytokrom P450.
Preparatet inneholder stoffet: Agalsidase beta
Refusjonert medikament: NEI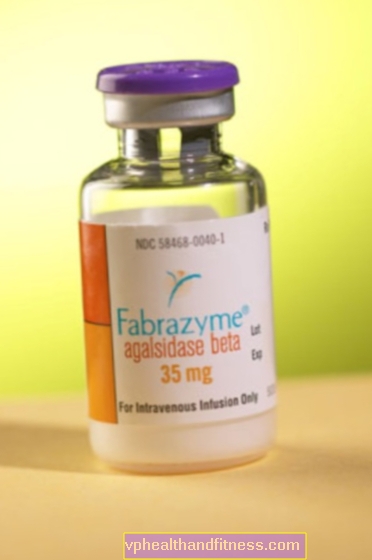


















---objawy-leczenie-i-zapobieganie-zakaeniu.jpg)

